
| IMGT Web resources |

|
| Here you are: IMGT Web resources > IMGT Education > Tutorials > Techniques immunologiques |
|
Texte résumé du chapitre 31 du livre IMMUNOLOGIE par REVILLARD Avec la collaboration de l'Association des Enseignants
d'Immunologie des Universités de Langue Française (ASSIM)
- 4ème édition 2001- DeBoeck
Université - ISBN2 - 8041 - 3805 - 4
Modifié par Marie-Paule Lefranc, avec l'autorisation du Professeur Jean-Pierre Revillard et de DeBoeck
Université (Mai 2003).
Ce Chapitre est dédié au Professeur Jean-Pierre Revillard.
La réaction antigène - anticorps (Ag-Ac) est due à l'interaction entre les épitopes de l' antigène et les paratopes de l'anticorps. Elle fait intervenir quatre types de liaisons non covalentes (des liaisons hydrogènes, des liaisons électrostatiques, des liaisons hydrophobes et les forces de Van der Waals). Les Ac constituent des sondes moléculaires spécifiques vis à vis de n'importe quelle substance antigénique.
La réaction Ag-Ac a deux grands types d'applications :
La détection et le dosage des antigènes (par des méthodes dont il faut vérifier la spécificité, la reproductibilité et la sensibilité).
La détection et le titrage des anticorps (vis-à-vis d'un Ag ou d'un mélange d'Ag).
|
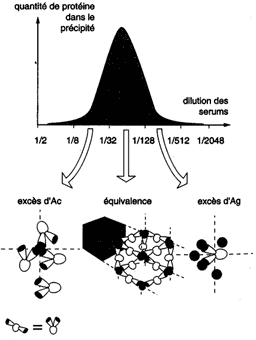
L'expérience consiste à répartir des quantités
égales d'un solution d'un Ag multivalent avec des dilutions
croissantes d'un sérum immun. La zone d'équivalence (qui est le point où la courbe atteint son maximum) correspond à la formation d'un réseau Ag-Ac. |
 |
Intérêt : Les méthodes de précipitation en milieu gélifié sont appliquées à l'analyse qualitative d'un mélange d'Ag dans une solution ou bien au dosage immunochimique d'un Ag.
1. Immunodiffusion double ou réaction d'Ouchterlony
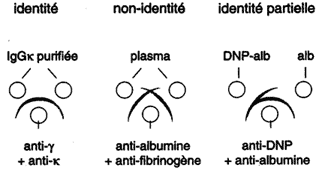
| Les solutions d'Ag et d'Ac sont déposées
dans des puits percés à distance les uns des autres
dans un gel d'agarose. Les molécules diffusent dans le gel
en fonction de leur taille et forment
des lignes de précipitation pour
chaque système d'Ag et d'Ac. Chaque ligne de précipitation correspond à la zone d'équivalence respective, c'est-à-dire à la formation d'un réseau Ag-Ac. Cette méthode permet l'analyse d'un mélange d'Ag et l'identification de ses constituants. Lorsque deux protéines diffusent dans un gel à la rencontre des Ac, on distingue des réactions d'identité, de non-identité ou d'identité partielle. |
 |
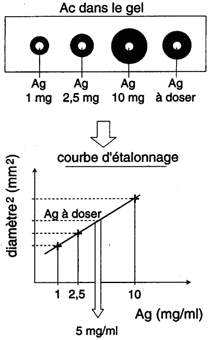
2. Immunodiffusion radiale (technique de Mancini)
| Cette méthode consiste à incorporer un antisérum spécifique dans la gélose et à déposer la solution d'Ag dans des puits. A l'équilibre il se forme un anneau de précipitation dont le carré du diamètre est proportionnel à la concentration de l'Ag. La concentration est exprimée par référence à une courbe standard avec un Ag de concentration connue. |
 |
3. Immunoélectrophorèse
Cette technique met en jeu une séparation des protéines par électrophorèse dans un gel d'agarose suivie d'une double diffusion contre des Ac spécifiques selon une direction perpendiculaire à l'axe de migration électrophorétique. Chaque zone d'équivalence correspond à un précipité Ag-Ac qui se traduit par un arc de précipitation. L'immunoélectrophorèse permet de caractériser ou d'identifier des antigènes (ce n'est pas une méthode quantitative).
4. Electrophorèse en fusée (rocket electrophoresis)
| L'Ac incorporé dans
le gel d'agarose est immobile (grâce au
pH du gel), l'Ag chargé négativement migre dans un champ
électrique. L'arc de précipitation résultant a la forme d'une fusée dont la hauteur est proportionnelle à la concentration de l'Ag. |
 |
5. Immunofixation
Après séparation de la solution antigénique par électrophorèse, un Ac spécifique est déposé à la surface du gel, il pénétre dans celui-ci et précipite en présence d'Ag correspondant. Cette méthode est plus sensible et rapide que l'immunoélectrophorèse, cependant on lui préfère l'immunotransfert (cf ci-dessous).
6. Immunotransfert ou western blot
L'Immunotransfert, ou western blot, est une technique pour l'analyse et l'identification des antigènes des protéines. Les protéines sont séparées par électrophorèse sur gel de polyacrylamide, puis transférées électrophorétiquement sur une membrane (de nitrocellulose, par exemple). Les bandes des protéines pour lesquelles on recherche les antigènes sont détectées par dépôt d'un Ac spécifique, suivi d'un second Ac marqué par un isotope, un fluorochrome ou une enzyme. Le nom 'western blot' a été donné par analogie à la technique Southern blot (utilisée pour les fragments d'ADN) et Northen blot, pour l'ARN.
La réaction d'agglutination met en présence des Ag sur un élément
figuré (cellules, érythrocytes, particules, bactéries) et un antisérum
contenant des Ac spécifiques agglutinants.
Cette méthode est largement appliquée à la détermination des groupes sanguins et à la détection d'Ac. |
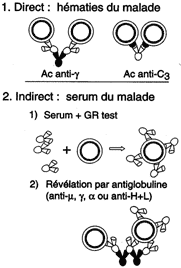
Test de Coombs |
 Hémagglutination en micro-plaques |
|
L'agglutination passive consiste à fixer un Ac soluble sur un support figuré inerte n'intervenant pas dans la réaction Ag-Ac. La présence d'Ac est décelée par l'agglutination des particules sur lesquelles l'Ag est fixé. Les applications sont très nombreuses : Cette réaction permet de rechercher la présence d'un Ag dans un liquide biologique. |
Dans les techniques d'immunomarquage, l'Ag, ou le plus souvent l'Ac, est marqué, c'est-à-dire qu'il est couplé à un isotope (ex : 125I), à un composé fluorescent (fluorochrome) ou à une enzyme (ex : peroxidase du raifort, phosphatase alcaline). La détection se fait au compteur à scintillation, au microscope en UV (immunofluorescence) ou en microscopie optique (techniques immunoenzymatiques).
1. Mise en évidence d'un antigène ou d'un Ac dans une suspension hétérogène
| Les techniques d'immunomarquage permettent d'identifier un Ag ou un Ac au sein d'une population hétérogène. |
|
2. Mise en évidence d'un antigène sur une coupe tissulaire
Les techniques d'immunomarquage permettent de localiser un Ag au sein d'un tissu sur un coupe tissulaire ou sur un frottis cellulaire (après fixation et perméabilisation de la membrane si nécessaire). Si l'Ac spécifique de l'Ag est couplé au fluorochrome ou à une enzyme, il s'agit de marquages directs. La sensibilité peut être augmentée par des marquages indirects dans lesquels l'Ac marqué n'est pas l'Ac spédifique de l'Ag mais un second Ac anti-Fc qui reconnait la région constante (Fc) de l'Ac primaire spécifique de l'Ag. Le deuxième Ac est couplé à un fluorochrome (immunofluorescence indirecte), ou à une enzyme.
3. Cytométrie de flux
| La cytométrie de flux permet la numération des cellules exprimant un Ag membranaire. La mesure du pourcentage de cellules est fonction de l'intensité de fluorescence liées aux Ag membranaires reconnus par des Ac spécifiques couplés à des fluorochromes. Ceci est réalisé à l'aide d'un analyseur de cellules : cytomètre de flux ou FACS (fluorescence activated cell sorter). Dans sa version sophistiquée, le cytomètre de flux permet aussi la séparation des cellules. |
|
| Le Cytomètre de flux enregistre l'intensité de fluorescence de chaque cellule passant devant la source laser. La détermination du seuil permet d'identifier et de séparer les cellules positives qui expriment l'Ag, des cellules négatives qui ne l'expriment pas. | 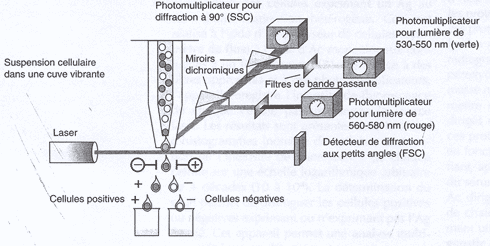 |
Ces techniques permettent de doser n'importe quel Ag en solution pour lequel on dispose d'Ac spécifiques. Elles sont caractérisées par leur très grande sensibilité.
1. Méthodes par compétition
|
Les techniques d'immunodosage par compétition
utilisent un Ac spécifique qui peut être couplé
à une phase solide et un antigène purifié marqué
soit à l'125I : RIA
(Radioimmunoassay) soit couplé à une enzyme : ELISA
(Enzyme-Linked Immunosorbent Assay). Par référence à une courbe étalon obtenue avec une concentration en Ag connue, il est possible de déterminer la concentration dans le liquide biologique. |
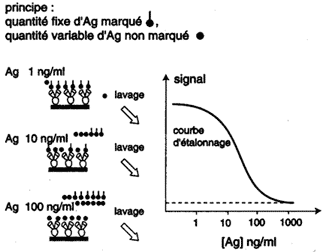 Immunodosage par compétition |
| Les méthodes dites "en sandwich" ( où l'Ag recherché se trouve entre deux couches d'Ac) utilisent non pas des Ag marqués mais un deuxième Ac marqué spécifique de l'Ag. Le signal obtenu augmente en fonction de la concentration d'Ag ajouté jusqu'à atteindre un plateau correspondant à la saturation de la réaction. |
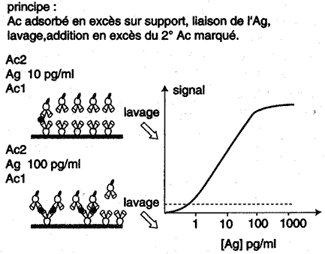 Immunocapture et révélation de l'antigène par un anticorps marqué ("sandwich") |
Created: 11/07/2003
Last updated:
Chapitre corrigé par D Bellet, JC Homberg, B Pau (1er éd.) 1994.
Résumé par Patrick Chastellan et Marie-Paule Lefranc