Présentation des antigènes par MHC-Ia à la surface d'une cellule infectée par un virus à ADN (ex : Adenoviridae)
I. Présentation de l'Adénovirus (Adenoviridae)
L'adenovirus est un virus dépourvu d'enveloppe (Stewart et al. 1993), possédant de l'ADN double brin linéaire (figure 1).
Les extrémités 5' de l'ADN viral sont liées de manière covalente à deux protéines de 55kDa nommées « protéines terminales » TP (Rekosh et al. 1977).
La capside icosaédrique est composée de 252 capsomères (240 hexons pour 12 pentons). Les capsomères situés aux sommets de l'icosaèdre sont des pentons prolongés par une ou deux fibres de longueur variable. Ces protubérances possèdent une partie C-terminale distale et globulaire appelée tête qui permet l'interaction du virus avec le récepteur primaire de la cellule cible. Les 240 autres capsomères (hexon) composent les 20 faces triangulaires de la capside.
Les protéines virales sont désignées par leurs numéros de polypeptide, à l'exception des protéines terminales.
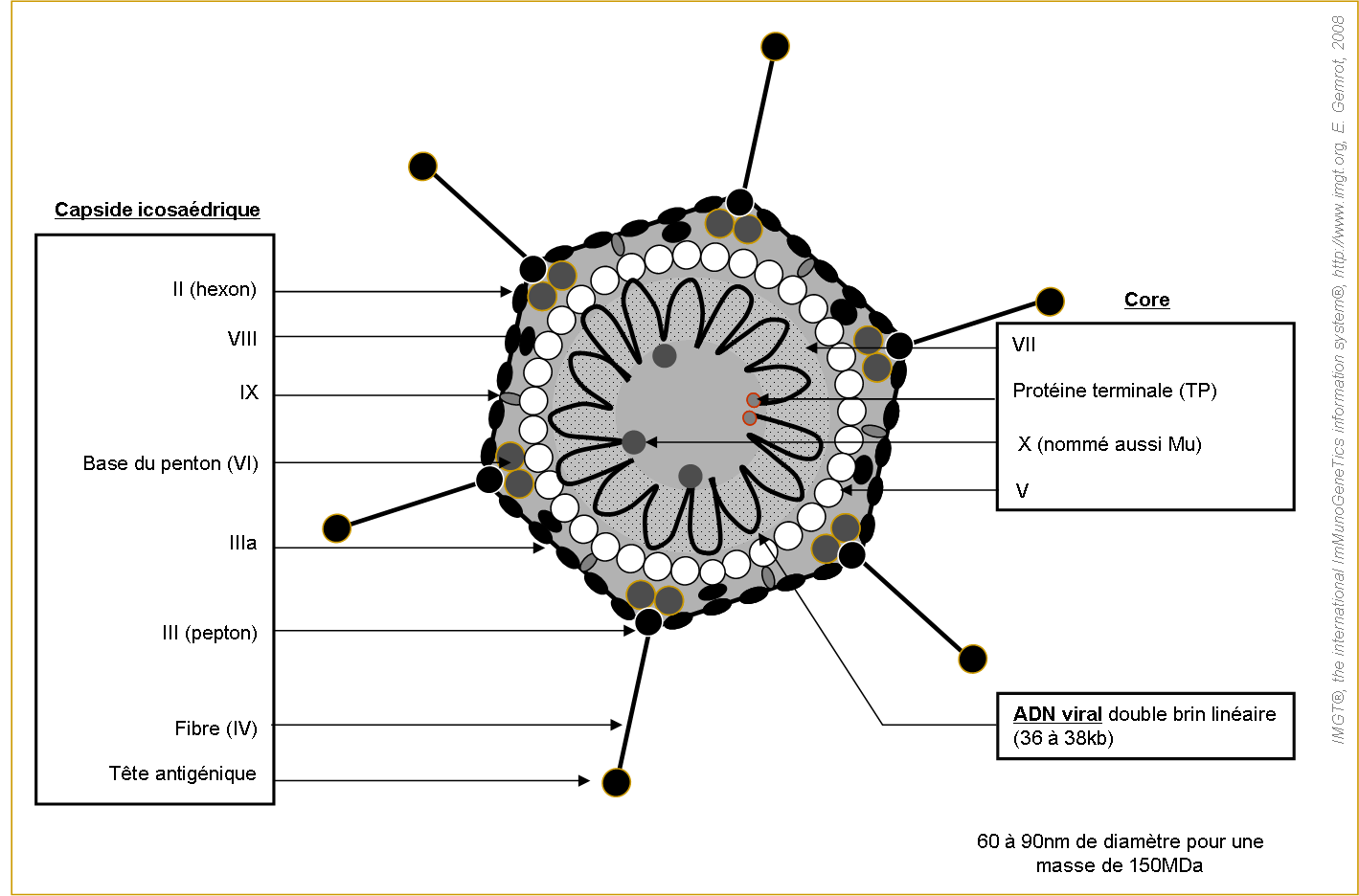 Figure 1. Morphologie de l'Adenovirus (d'après Brown et al. 1975).
Figure 1. Morphologie de l'Adenovirus (d'après Brown et al. 1975).
IIIa, VI, VIII et IX sont des protéines consolidatrices dites également protéines ciment de la capside.
Le génome viral peut être divisé en 2 parties : les régions E (pour early) participent à la phase précoce du cycle de réplication du virus tandis que les régions L (pour late) interviennent lors de la phase tardive (figure 2).
 Figure 2. Organisation du génome de l'Adenovirus de type 2 (Akusjïrvi et al. 1989).
Figure 2. Organisation du génome de l'Adenovirus de type 2 (Akusjïrvi et al. 1989).
"p" indique les précurseurs. MLP sont les initiales de major late promotor site. Le poids des protéines est exprimé en kilo dalton. Les flèches indiquent le sens relatif de la transcription des régions. Le schéma prend en compte les promoteurs des différents gènes d'une région.
II. Fonctions des gènes de l'Adénovirus
Tableau 1. Fonction des gènes de l'Adénovirus (figures 4 et 6):
| Phase | Gènes | Fonctions des protéines |
|---|---|---|
| Précoce | E1A | - Code des protéines régulatrices de l'expression de gènes viraux et cellulaires (289R : protéine stimulatrice et 243R : protéine répressive) (figure 5). - Induit la mitose (phase S) des cellules et les cycles de réplication du virus; ce qui entraine l'accumulation des protéines d'apoptoce cellulaire p53 et BAK (Villunger et al. 2003) (figure 4). |
| E1B | - Code pour les protéines E1-19kDA et E1-55kDa. - Induit la mitose des cellules en adéquation avec E1A. - Inhibition de l'apoptose cellulaire : E1B-19kDa se fixe sur les protéines cellulaires apoptotiques BAK (BLC-2 antagonist/killer) et BAX (BCL-2-associated X-proteine) (Perez et al. 2000, Sundararajan et al. 2001a, Sundararajan et al. 2001b, Cuconati et al. 2002 et Cuconati et al. 2003) tandis que E1B-55kDa interagit sur la protéine apoptotique cellulaire p53 (White 2001 et Berk 2005). |
|
| E2A /E2B | - Codent pour les protéines DBP (E2A), pTP et Ad-pol (E2B). - Interviennent lors de la réplication de l'ADN viral ainsi que dans la régulation de l'expression des gènes tardifs (Hay et al. 1995). - Les protéines TP permettent la pénétration du virus dans le noyau de la cellule hôte et sa circularisation (en libérant les bouts collants de l'ADN double brin viral). |
|
| E3 | - Code pour les protéines 12.5kDa, 6.7kDa, gp19kDa, 11.6kDa, ADP, RIBαβ, 14.1:14.5kDa et 14.7kDa. - Les protéines 12.5kDa:6.7kDa ont des fonctions inconnues. - La protéine gp19kDa module la réponse immunitaire en se fixant sur les MHC-Ia et en bloquant leur adressage à la surface cellulaire (Bennett et al. 1999). - Les protéines 11.6kDa et ADP (adenovirus death protein) favorisent la libération du virus hors de la cellule hôte (Tollefson et al. 1996). - Les protéines 10.4kDa :14.5kDa, 14.7kDa et RIBα/β inhibent des voies d'apoptose (Wold et al. 2000) en inhibant entre autres les protéines TNF (tumor necrosis factor). |
|
| E4 | - Code pour les protéines orf 3, 4, 6 et 7. - intervient dans la régulation transcriptionnelle des gènes précoces et tardifs viraux en adéquation avec E1A et est impliqué dans la réplication de l'ADN viral (E4orf3 et 6) (Bridge et al. 1989 et Huang et al. 1989). - A une action sur le transport des ARNm viraux (Goodrum et al. 1999 et Weigel et al. 2000). - Intervient dans l'assemblage des virions. - Est associé à la résistance du virus contre la lyse par les lymphocytes T CD8+ (Kaplan et al. 1999). - Arrête l'expression génétique de la cellule hôte (Halbert et al. 1985) par la modulation de l'expression de p53 et du facteur de transcription E2F (E4orf4 : inhibe l'activation de E1A sur le promoteur E2F (Mannervik et al. 1999) tandis que E4orf 6/ 7 : modulent l'activité de E2F). - Bloque la voie d'accès à l'apoptose p53 : E4orf6 (Boyer et al. 2000) et E4orf3 (Konig et al. 1999) inhibent E1B-55kDa tandis que E4orf 4 et 6 inhibent l'action du gène p53 par l'ADN protéine kinase. - Induit l'apoptose de façon indépendante de la cellule hôte. |
|
| Intermédiaire | Gènes IX et Iva2 | - Codent les protéines du packaging. - La protéine Iva2 transactive le promoteur tardif MLP. |
| Précoce et Tardive | L1 à L5 | - Les protéines des gènes L5 (protéine IV) et I2 permettent l'adsorption et pénétration du virus dans la cellule hôte. - Les protéines des gènes L1 (IIIa, 55kDa), L2 (III, pVII, V, 8.7kDa), L3 (pVI, II, Pr) et L4 (100kDa, 33kDa, pVIII) permettent l'assemblage des particules virales lors de la phase tardive. |
III. Les différents types de cycles de l'Adénovirus
Les adénovirus peuvent réaliser trois types de cycles différents dans une cellule hôte :
- le cycle « lytique » ou « infectieux» qui aboutit à la production de nouvelles particules virales et à la lyse de la cellule infectée (cas d'une infection d'une cellule permissive) ;
- le cycle « abortif » n'aboutit à aucune particule virale (cas d'une infection d'une cellule non permissive) ;
- et le cycle « transformant» déclenche le développement de tumeurs cancéreuses (cas d'une infection d'une cellule permissive ou non).
IV. Infection d'une cellule par l'Adenovirus
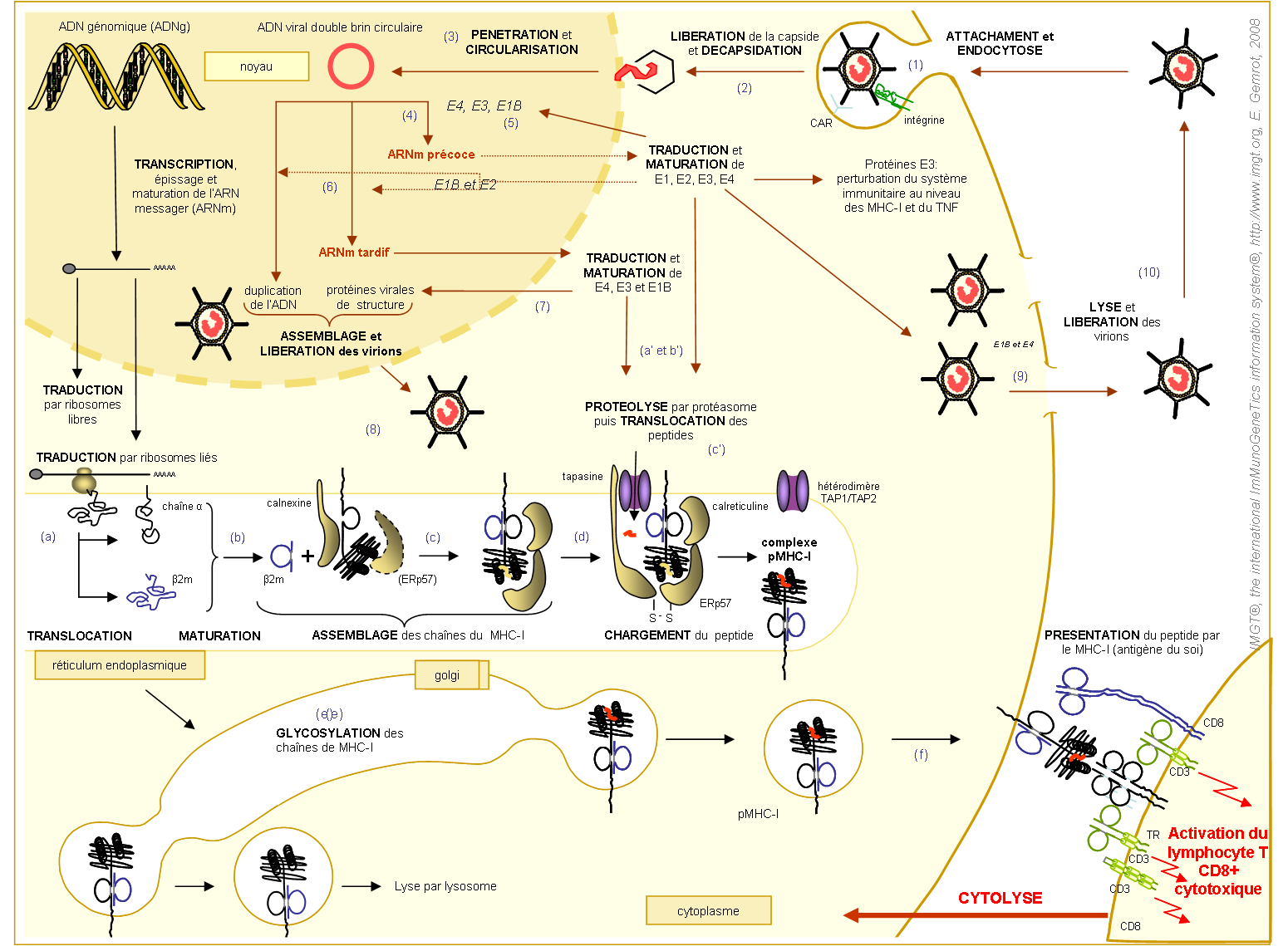 Figure 3. Cycle de réplication des Adenovirus, étapes de l'expression à la surface cellulaire d'un complexe pMHC-Ia et présentation d'un peptide exogène viral par MHC-Ia au récepteur T d'un lymphocyte T CD8+.
Figure 3. Cycle de réplication des Adenovirus, étapes de l'expression à la surface cellulaire d'un complexe pMHC-Ia et présentation d'un peptide exogène viral par MHC-Ia au récepteur T d'un lymphocyte T CD8+.
S'agissant d'un peptide viral (en rouge), le lymphocyte T CD8+ est activé. En résulte la destruction de la cellule infectée par cytolyse. La voie de dégradation des peptides protéiques est indiquée par les lettres « a' » à « c' ». La voie de biosynthèse des MHC-I et de leur chargement en peptides sont indiqués par les lettres « a » à « f ». Le cycle de réplication de l'Adenovirus est indiqué par les chiffres de « 1 » à « 10 » et détaillé ci-dessous.
Cycle de réplication de l'Adenovirus (figure 3)
Le cycle infectieux de l'Adénovirus peut être clairement divisé en deux phases : la phase précoce et la phase tardive ; séparées par la réplication de l'ADN viral. La phase précoce peut durer approximativement de 6 à 8 h (suivant certains facteurs), tandis que la phase tardive est beaucoup plus rapide (4 à 6 h).
La phase précoce couvre la pénétration du virus dans la cellule hôte, le passage du génome du virus dans le noyau et la biosynthèse des protéines codées par les gènes des régions E (gènes nécessaires à la multiplication virale). Les protéines précoces produites modulent les fonctions de la cellule hôte afin de faciliter la réplication de l'ADN viral et la biosynthèse des protéines tardives.
Lors de la phase tardive, les particules virales sont assemblées dans le noyau de la cellule hôte. Ddans le cas de cycle lytique, les protéines d'apoptose (cellulaires et virales) accumulées dans la cellule permettent de lyser la cellule hôte et de ce fait, propager les virus nouvellement formés.
(1) L'infection adénovirale débute par la reconnaissance du récepteur primaire d'une cellule hôte par la tête de la fibre virale. A ce jour, plusieurs récepteurs primaires ont été identifiés suivant le sous-groupe auquel appartient le virus (tableau 1). Le récepteur cellulaire transmembranaire de la superfamille des immunoglobulines CAR (Coxsackie and Adenovirus Receptor de 46kD) (Bergelson et al. 1997) est le récepteur le plus reconnu par l'Adenovirus.
Tableau 2. Principaux récepteurs de l'adénovirus :
| Récepteur | Localisation cellulaire | Famille | Interactions | Type de récepteur vis-à-vis de l'adénovirus |
|---|---|---|---|---|
| CAR | Ubiquitaire à la surface des tissus cellulaires humains. | Superfamille des immunoglobulines IgSF. | Boucles AB et DE des fibres du virus avec la protéine CAR. | Récepteur primaire le plus utilisé par les sous groupes A, C, D, E, F (a). |
| Acide sialique | Charge dépendante (e) et stabilisée par des liaisons hydrogènes. | Récepteur primaire alternatif du sous-groupe D (b). | ||
| CD46 | Majorité des tissus cellulaires humains. | Liaisons de type Van Der Waals et hydrogènes avec les boucles HI et DG des fibres. | Récepteur primaire du sous-groupe B (c). | |
| CD80/86 | Lymphocytes T CD8+. | Superfamille des immunoglobulines IgSF. | Récepteur primaire du sous-groupe B (d). | |
| D'autres récepteurs alternatifs sont encore à l'étude : MHC-I pour HAd2 et HAd5 (f) ou encore CD106 pour HAd5 (g) et héparanes sulfates (HS) pour HAd2 et HAd5 (sous-groupe C) (h). | ||||
(a) Bergelson et al.1997, Roelvink et al.1998, Bewley et al. 1999 et Burmeister et al. 2004. (b) Stevenson et al.1995 et Roelvink et al. 1998. (c) Fleischli et al. 2007, Persson et al. 2007, Seiradake et al. 2006 et Burmeister et al. 2004. (d) Short et al. 2004 et Short et al. 2006. (e) Burmeister et al. 2004. (f) Hong et al. 1997. (g) Chu et al. 2001. (h) Dechecchi et al. 2000 et Dechecchi et al. 2001.
L'attachement de la tête de la fibre virale avec le domaine extracellulaire D1 du récepteur primaire CAR induit un changement de conformation du virus qui rend accessible le motif RGD (Arginine - Glycine - Acide Aspartique) situé à la base du penton (Stewart et al.1997).
Il s'en suit, une interaction entre 5 motifs RGD et plusieurs molécules d'intégrines cellulaires (Wickham et al. 1993 et Li et al. 2001a) ; telles les intégrines αvβ3, αvβ5 (Wickham et al. 1993), αvβ1 (Li et al. 2001b), α5β1 (Davison et al. 1997), αMβ2 et αLβ1 (Huang et al. 1996).
L'association penton-intégrine induit un certain nombre de voies de signalisation qui polymérisent et réorganisent l'actine de la membrane cellulaire initiant ainsi l'entrée du virus dans la cellule hôte par endocytose (Li et al. 1998 et Rauma et al. 1999).
Notons que le mode d'internalisation de certaines espèces d'adénovirus reste encore inconnu car ils ne possèdent pas de séquence RGD au niveau des bases du penton (ex : virus animaux).
(2) L'endosome subit ensuite une acidification qui dissocie les protéines IIIa et VIII. Les mécanismes de décapsidation et de libération de L'ADN viral ne sont pas totalement connus, cependant, il semblerait que le démantèlement de la capside virale soit entre autre dû à une protéolyse en partie réalisée par la protéase virale (Greber et al. 1996).
(3) Une fois libéré, L'ADN double brin viral pénètre rapidement dans le noyau de la cellule infectée via les pores nucléaires, les microtubules (Leopold et al. 2000 et Suomalainen et al. 1999), des protéines virales (TP, V, VII et Mu) et une protéine cellulaire (p32) (Matthews et al. 1998). La protéine p32 est une composante d'un système de transport entre les mitochondries et le noyau cellulaire. Le virus détourne ce système afin d'avoir accès au noyau.
Une fois à l'intérieur du noyau, le génome viral se circularise. En effet, les deux brins possèdent à leurs extrémités des séquences répétées inversées (inverted terminal repeats : ITRs), de 100 à 140 bp, qui permettent aux molécules monocaténaires de se circulariser (Arrand et al. 1979). Les ITRs serviront ultérieurement d'origine de réplication.
(4) Le virus entame ensuite la phase précoce immédiate (figure 4).
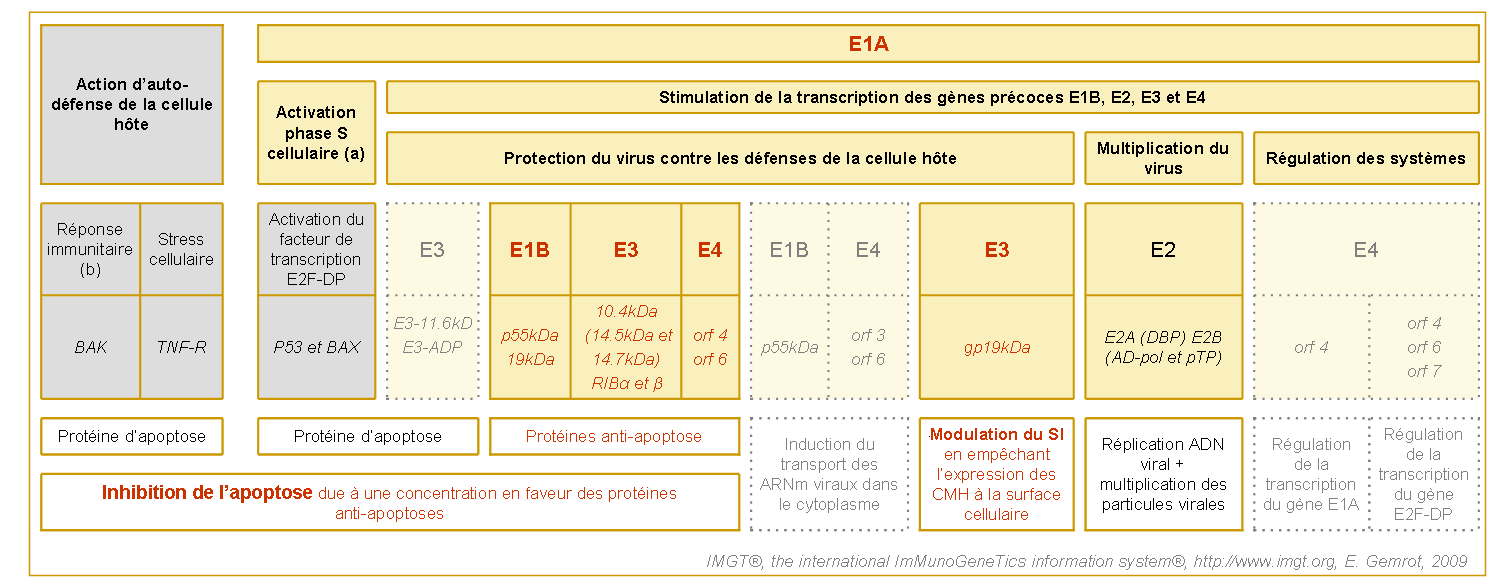 Figure 4. Principales interactions entres les gènes et protéines viraux exprimés lors des la phase précoce (Grill et al. 2003).
Figure 4. Principales interactions entres les gènes et protéines viraux exprimés lors des la phase précoce (Grill et al. 2003).
Les gènes et protéines adénoviraux sont indiqués dans les cadres jaunes.
Les gènes et protéines cellulaires sont indiqués dans les cadres gris.
Les protéines sont en italliques.
La protéine p53 est un facteur de transcription du gène BAX. Les protéines E2F et DP sont des facteurs de transcription des gènes de la phase S cellulaire (mitose).
Lors de la phase S cellulaire (a), la CDK (cyclin-cyclin kinase) phosphoryle la partie pRb du complexe pRb-E2F-DP.
Lors des phases G0 et G1, la CDK est inhibée par la CKI. La réponse immunitaire (b) induit la dégradation de l'inhibiteur de BAK par le protéasome.
Les protéines d'apoptose E3 et E4 sont en faible concentration, et les protéines d'apoptose de la cellule hôtes sont inhibées.
Lors de cette phase, les gènes issus des régions E1A sont transcrits et traduits (environ 1h après le début de l'infection). Les protéines de la région E1A stimulent la transcription d'autres régions E du virus (E1B, E2, E3, E4), mais active aussi le cycle cellulaire de la cellule hôte en rendant actif les facteurs de transcription E2F-DP (figure 5) (Frisch et al. 2002).
Le changement de rythme de la mitose de la cellule infectée induit l'accumulation de protéines responsables de l'apoptose cellulaire (dont p53, BAX...) (Villunger et al. 2003). Afin d'enrailler la lyse de la cellule infectée avant la multiplication des particules virales, l'adénovirus va inhiber différentes voies d'apoptose lors de la phase précoce. Pour ce faire, le virus utilise diverses stratégies visant à bloquer la sortie des ARNm des protéines apoptotiques ou à empêcher leur traduction voir même à inhiber leur fonction. Ces tactiques sont commanditées par différentes protéines codées par les régions E1B (E1B-19kDa et E1B-55kDa), E3 (10.4kDa :14.5kDa, 14.7kDa et RIBαβ) et E4 (orf 3, 4, 6/7).
Parallèlement, afin de contrecarrer les défenses immunitaires, la protéine E3-gp19kDa empêche les molécules du MHC-I d'être exprimées à la surface de la cellule (Bennett et al. 1999).
D'autres protéines favorisent le métabolisme du virus. Ainsi l'association des protéines E1B (E1B-55kD) et E4 (E4-34kD) induit le transport des ARNm viraux dans le cytoplasme de la cellule hôte (Goodrum et al. 1999 et Weigel et al. 2000).
La régulation de l'expression des protéines précoces répond à des règles complexes et nécessite de multiples promoteurs. Les acteurs principaux sont les protéines issues de la région E1A, E1B (E1B-55kDa) et E4 (orf3, 4, 6 et 7). Ainsi, suivant la concentration en protéines de types E1A et E4, les protéines précoces des autres régions génomiques du virus (E1B, E2, et E3) vont être traduites. De la même manière, si la concentration en E4orf4 est trop importante, l'expression de la région E1A peut être réprimée.
Il est à noter que ces protéines sont toutes traduites et amenées à maturité au niveau du cytoplasme de la cellule hôte. Puis elles sont toutes adressées au niveau du noyau de la cellule. Par contre, une partie des protéines de types E1B, E3 et E4 reste dans le cytoplasme de la cellule pour inhiber le système immunitaire (E3-gp19kDa) ou permettre l'apoptose cellulaire par des protéines virales (E3-11.6kD et E3-ADP, et E4) lorsqu'elles sont hautement concentrées.
(5) La réplication nécessite dans un premier temps la transcription et la traduction des gènes viraux: ADN pol, pTP et DBP (DNA Binding Protein se liant au simple brin) codés par les régions E2A et E2B (Hay et al. 1995).
L'expression de ces gènes résulte de l'association du facteur de transcription E2F-DP et des protéines E4-orf6/7 (figure 5).
Pendant la réplication, le brin non copié est protégé des nucléases par les DBP.
 Figure 5. Activation de la transcription des gènes de la région E2.
Figure 5. Activation de la transcription des gènes de la région E2.
L'illustration est réalisée d'après Frisch et al. 2002. Tbp est une protéine d'initiation, TfIId.
La protéine E1A-289R se lie à la protéine rétinoblastome (pRb), en perturbant le complexe pRb-E2F-DP. En résulte le complexe E1A-pRb et le facteur de transcription E2-DP libre.
Le facteur de transcription E2F-DP s'associe alors avec les protéines E4-orf6/7 sur des promoteurs, stimulant des gènes impliqués dans la transition G1 -> S de la cellule et la réplication du génome du virus.
(6) Lors de la phase tardive (figure 6), les protéines structurales et d'assemblage de la capside du virus sont simultanément transcrites, traduites et subissent une maturation. Cette particularité est due au fait que ces protéines soient régulées par un même promoteur nommé MLP (Major Late Promoteur) (figure 2).
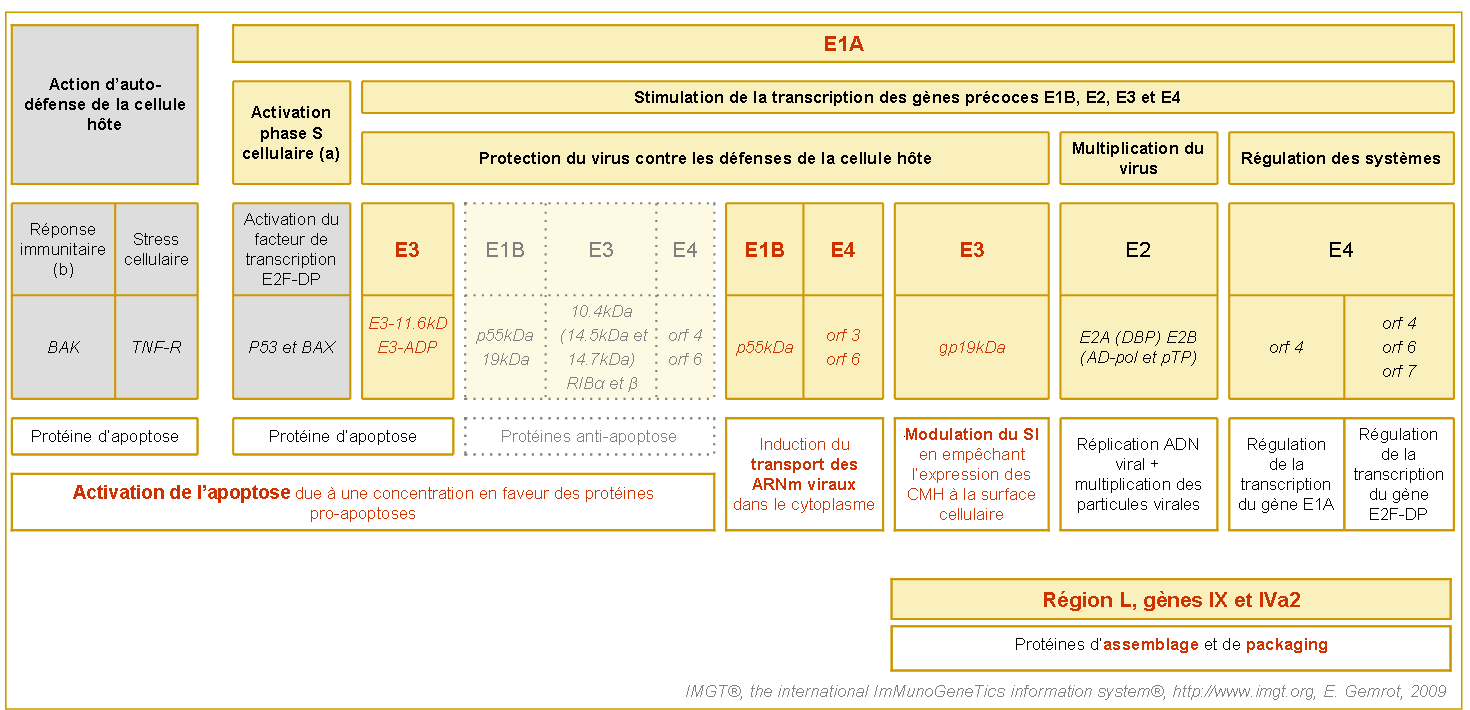 Figure 6. Principales interactions entres les gènes et protéines viraux exprimés lors des la phase tardive (Grill et al. 2003).
Figure 6. Principales interactions entres les gènes et protéines viraux exprimés lors des la phase tardive (Grill et al. 2003).
Les gènes et protéines adénoviraux sont indiqués dans les cadres jaunes. Les gènes et protéines cellulaires sont indiqués dans les cadres gris. Les protéines sont en italliques.
Ainsi, les protéines VII et X participent au compactage du génome (Van Oostrum et al. 1985 et Anderson et al. 1989) tandis que la protéine V intervient dans le maintien du nucléoïde (Everitt et al. 1975 et Chatterjee et al. 1989) au niveau de la capside.
L'adénovirus transcrit également une série d'ARN non traduits, appelée « ARN VA ». Ces derniers jouent un rôle dans la lutte contre les mécanismes de défense cellulaire en bloquant l'expression des messagers cellulaires (interféron).
(7) L'assemblage des virions se réalise dans le noyau. Puis le virus migre dans le cytoplasme.
(8) La concentration en protéines lytiques augmente progressivement jusqu'à atteindre une teneur suffisante pour induire l'apoptose de la cellule et la libération des virions.
(9) La nouvelle particule virale est alors relarguée en dehors de la cellule et entame un nouveau cycle de réplication.
IV. Bibliographie
Akusjärvi, G., Pettersson, U., Roberts R.J., Structure and function of the adenovirus-2 genome. In Doerfler W (ed): Adenovirus DNA. Martinus Nijhoff, Boston, (1986).
Anderson, C.W., Young, M.E., Flint, S.J., Characterization of the adenovirus 2 virion protein, mu, Virology, 172, 506-12 (1989).
Arrand, J.R., Roberts, R.J., The nucleotide sequence at the termini of adenovirus 2 DNA, J. Mol. Biol., 128, 577-594 (1979).
Bennett, E.M., Bennink, J.R., Yewdell, J.W., Brodsky, F.M., Cutting edge: adenovirus E19 has two mechanisms for affecting class I MHC, expression. J. Immunol., 162, 5049-5052 (1999).
Berk, A.J., Recent lessons in gene expression, cell cycle control, and cell biology from adenovirus, Oncogene, 24, 7673-7685 (2005).
Bergelson, J.M., Cunningham, J.A., Droguett, G., Kurt-Jones, E.A., Krithivas, A., Hong, J.S., Horwitz, M.S., Crowell, R.L., Finberg, R.W., Isolation of a common receptor for coxsackie B viruses and adenoviruses 2 and 5, Science, 275, 320-1323 (1997).
Bewley, M.C., Springer, K., Zhang, Y.B., et al., Structural analysis of the mechanism of adenovirus binding to its human cellular receptor, CAR, Science, 286, 1579-83 (1999).
Boyer, J. L., Ketner, G., Genetic analysis of a potential zinc-binding domain of the adenovirus E4 34k protein, Journal of Biological Chemistry, 275, 14969-14978 (2000).
Bridge, E., Ketner, G., Redundant control of adenovirus late gene expression by early region 4, J. Virol., 63, 631-638 (1989).
Brown, D.T., Westphal, M., Burlingham, B.T., Structure and composition of the adenovirus type 2 core, J. Virol. 16, 366 (1975).
Burmeister, W.P., Guilligay, D., Cusack, S., Crystal structure of species D adenovirus fiber knobs and their sialic acid binding sites, J. Virol., 78, 7727-36 (2004).
Chatterjee, P.K., Vayda, M.E., Flint, S.J., Interactions among the three adenovirus core proteins, J. Virol., 55, 379-86 (1985).
Chu, Y., Heistad, D., Cybulsky M.I., Vascular cell adhesion molecule-1 augments adenovirus-mediated gene transfer, Arterioscler Thromb Vasc Biol, 21, 238-42 (2001).
Cuconati, A., Degenhardt, K., Sundararajan, R., Anschel, A., White, E., BAK and BAX function to limit adenovirus replication through apoptosis induction, J. Virol., 76, 4547-4558 (2002).
Cuconati, A., Mukherjee, C., Perez, D., White, E., DNA damage response and MCL-1 destruction initiate apoptosis in adenovirus-infected cells, Genes Dev, 17, 2922-2932 (2003).
Davison, E., Diaz, R.M., Hart, I.R., and al., Integrin α5β1-mediated adenovirus infection is enhanced by the integrin-activating antibody TS2/16, J. Virol., 71, 6204-7 (1997).
Dechecchi, M.C., Tamanini, A., Bonizzato, A., and al., Heparan sulfate glycosaminoglycans are involved in adenovirus type 5 and 2-host cell interactions, Virology, 268, 382-90 (2000).
Dechecchi, M.C., Melotti, P., Bonizzato, A., and al. Heparan sulfate glycosaminoglycans are receptors sufficient to mediate the initial binding of adenovirus types 2 and 5, J. Virol., 75, 8772-80 (2001).
Everitt, E., Lutter, L., Philipson, L., Structural proteins of adenoviruses. XII. Location and neighbor relationship among proteins of adenovirion type 2 as revealed by enzymatic iodination, immunoprecipitation and chemical cross-linking, Virology, 67, 197-208 (1975).
Fleischli, C., Sirena, D., Lesage, G., and al., Species B adenovirus serotypes 3, 7, 11 and 35 share similar binding sites on the membrane cofactor protein CD46 receptor, J Gen Virol, 88, 2925-34 (2007).
Frisch, S.T., Joe, S., Mymryk Adenovirus-5 E1A: paradox and paradigm, Nature Reviews Molecular Cell Biology, 3, 441-452 (2002).
Greber, U.F., Webster, P., Weber, J., Helenius, A., The role of the adenovirus protease on virus entry into cells, EMBO J., 15, 1766-1777 (1996).
Grill, J., Geoerger, B., Lamfers, M., Dirven, C., Van Beusechem, V., Gerritsen, W., Vassal, G., Les adénovirus réplicatifs conditionnels : un second souffle pour la thérapie génique du cancer, Bulletin du Cancer, 90(12), 1039-48 (2003).
Goodrum, F.D., Ornelles, D.A., Roles for the E4 orf6, orf3, and E1B 55-kilodalton proteins in cell cycle-independent adenovirus replication, J. Virol., 73, 7474-7488 (1999).
Halbert, D. N., Cutt, J. R., Shenk, T., Adenovirus early region 4 encodes functions required for efficient DNA replication, late gene expression, and host cell shutoff, J. Virol., 56, 250-257 (1985).
Hay, R. T., Freeman, A., Leith, I., Monaghan, A., Webster, A., Molecular interactions during adenovirus DNA replication, Molecular Repertoire of Adenoviruses, 1995, 31-48, Edited by W. Doerfler & P. Bohm. Berlin: Springer.
Hong, S.S., Karayan, L., Tournier, J., and al., Adenovirus type 5 fiber knob binds to MHC class I alpha2 domain at the surface of human epithelial and B lymphoblastoid cells, EMBO J. 16, 2294-306 (1997).
Huang, M.M., Hearing, P., Adenovirus early region 4 encodes two gene products with redundant effects in lytic infection, J. Virol., 63, 2605-2615 (1989).
Huang, S., Kamata, T., Takada, Y., and al., Adenovirus interaction with distinct integrins mediates separate events in cell entry and gene delivery to hematopoietic cells, J. Virol., 70, 4502-8 (1996).
Kaplan, J.M., Armentano, D., Scaria, A., Woodworth, L.A., Pennington, S.E., Wadsworth, S.C., Smith, A.E., Gregory, R. J., Novel role for E4 region genes in protection of adenovirus vectors from lysis by cytotoxic T lymphocytes, J. Virol., 73, 4489-4492 (1999).
Konig, C., Roth, J., Dobbelstein, M., Adenovirus type 5 E4orf3 protein relieves p53 inhibition by E1B-55-kilodalton protein, J. Virol., 73, 2253-2262 (1999).
Leopold, P.L., Kreitzer, G., Miyazawa, N., Rempel, S., Pfister, K.K., Rodriguez-Boulan, E., Crystal, R.G., Dynein- and microtubule-mediated translocation of adenovirus serotype 5 occurs after endosomal lysis, Human Gene Therapy, 11, 151-165 (2000).
Li, E., Stupack, D., Bokoch, G.M., Nemerow, G.R., Adenovirus endocytosis requires actin cytoskeleton reorganization mediated by Rho family GTPases, J. Virol., 72, 8806-8812 (1998).
Li, E., Brown, S.L., Stupack, D.G., and al., Integrin alpha (v) beta1 is an adenovirus coreceptor, J. Virol., 75, 5405-9 (2001a).
Li, E., Brown, S.L., Stupack, D.G., Puente, X.S., Cheresh, D.A., and Nemerow, G.R., Integrin αvβ1 is an adenovirus coreceptor, J. Virol., 75, 5405-5409 (2001b).
Mannervik, M., Fan, S., Strom, A. C., Helin, K., Akusjarvi, G., Adenovirus E4 open reading frame 4-induced dephosphorylation inhibits E1A activation of the E2 promoter and E2F-1-mediated transactivation independently of the retinoblastoma tumor suppressor protein, Virology, 256, 313-321 (1999).
Matthews, D.A., Russell, W.C., Adenovirus core protein V interacts with p32 - a protein which is associated with both the mitochondria and the nucleus, J. Gen. Virol., 79, 1677-1685 (1998).
Perez, D., White, E., TNF- signals apoptosis through a Bid-dependent conformational change in Bac that is inhibited by E1B 19K, Mol. Cell, 6, 53-63 (2000).
Persson, B.D., Reiter, D.M., Marttila, M., and al., Adenovirus type 11 binding alters the conformation of its receptor CD46, Nat. Struct. Mol. Biol., 14, 164-6 (2007).
Rauma, T., Tuukkanen, J., Bergelson, J.M., Denning, G., Hautala, T., rab5 GTPase regulates adenovirus endocytosis, J. Virol., 73, 9664-9668 (1999).
Rekosh, D.M., Russell, W.C., Bellet, A.J., Robinson, A.J., Identification of a protein linked to the ends of adenovirus DNA, Cell, 11, 283-295 (1977).
Roelvink, P.W., Lizonova, A., Lee, J.G., Li, Y., Bergelson, J.M., Finberg, R.W., Brough, D.E., Kovesdi, I., Wickham, T. J., The coxsackievirus-adenovirus receptor protein can function as a cellular attachment protein for adenovirus serotypes from subgroups A, C, D, E, and F, J. Virol., 72, 7909-7915 (1998).
Seiradake, E., Lortat-Jacob, H., Billet, O., and al., Structural and mutational analysis of human Ad37 and canine adenovirus 2 fiber heads in complex with the D1 domain of coxsackie and adenovirus receptor, J. Biol. Chem., 281, 33704-16 (2006).
Stewart, P.L., Fuller, S.D., Burnett, R.M., Difference imaging of adenovirus: bridging the resolution gap between X-ray crystallography and electron microscopy, EMBO J., 12, 2589-2599 (1993).
Stewart, P.L., Chiu, C.Y., Huang, S., Muir, T., Zhao, Y., Chait, B., Mathias, P., Nemerow, G. R., Cryo-EM visualization of an exposed RGD epitope on adenovirus that escapes antibody neutralization, EMBO J., 16, 1189-1198 (1997).
Sundararajan, R., Cuconati, A., Nelson, D., White, E., Tumor necrosis factor- induces Bax-Bak interaction and apoptosis, which is inhibited by adenovirus E1B 19K, J. Biol. Chem., 276, 45120-45127 (2001).
Sundararajan, R., White, E., E1B 19K blocks Bax oligomerization and tumor necrosis factor alpha-mediated apoptosis, J. Virol., 75, 7506-7516 (2001).
Suomalainen, M., Nakano, M.Y., Keller, S., Boucke, K., Stidwill, R.P. , Greber, U.F., Microtubule-dependent plus- and minus end-directed motilities are competing processes for nuclear targeting of adenovirus, Journal of Cell Biology, 144, 657-672 (1999).
Short, J.J., Pereboev, A.V., Kawakami, Y., and al., Adenovirus serotype 3 utilizes CD80 (B7.1) and CD86 (B7.2) as cellular attachment receptors, Virology, 322, 349-59 (2004).
Short, J.J., Vasu, C., Holterman, M.J., and al., Members of adenovirus species B utilize CD80 and CD86 as cellular attachment receptors, Virus Res., 122, 144-53 (2006).
Stevenson, S.C., Rollence, M., White, B., Weaver, L., McClelland, A., Human adenovirus serotypes 3 and 5 bind to two different cellular receptors via the fiber head domain, J. Virol., 69, 2850-2857 (1995).
Tollefson, A.E., Ryerse, J.S., Scaria, A., Hermiston, T.W., Wold, W. S., The E3-11-6-kDa adenovirus death protein (ADP) is required for efficient cell death: characterization of cells infected with adp mutants, Virology, 220, 152-162 (1996).
Van Oostrum, J., Burnett, R.M., Molecular composition of the adenovirus type 2 virion, J. Virol., 56, 439-48 (1985).
Villunger, A., Michalak, E.M., Coultas, L., Mullauer, F., Bock, G., Ausserlechner, M.J., Adams, J.M., Strasser, A, p53- and drug-induced apoptotic responses mediated by BH3-only proteins Puma and Noxa, Science, 302, 1036-1038 (2003).
Weigel, S., Dobbelstein, M.,The nuclear export signal within the E4orf6 protein of adenovirus type 5 supports virus replication and cytoplasmic accumulation of viral mRNA, J. Virol., 74, 764-772 (2000).
Wickham, T.J., Mathias, P., Cheresh, D.A., and al., Integrins alpha v beta 3 and alpha v beta 5 promote adenovirus internalization but not virus attachment, Cell, 73, 309-19 (1993).
White, E. Regulation of the cell cycle and apoptosis by the oncogenes of adenovirus, Oncogene, 20:7836-7846 (2001).
Wold, W.M., Chinnadurai, G., Adenovirus proteins that regulate apoptosis, In DNA Virus Replication, 200-232, Edited by A. J. Cann, Oxford:Oxford University Press (2000).



