Présentation des antigènes par MHC-Ia à la surface d'une cellule infectée par une bactérie pathogène (ex : Listeria monocytogenes)
I. Présentation de la Listeria monocytogenes
La Listeria monocytogenes est un petit bacille gram + saprophyte, mobile (péritriche) et ubiquitaire, largement répandu dans la nature (flore commensale, aliments crus d'origine animale, légumes crus, herbes aromatiques).
Description de la morphologie des bacilles gram +.
La Listeria monocytogenes est une anthropo-zoonose (Czuprynski et al. 2005). Les infections qu'elle provoque peuvent se manifester sous diverses formes telles que la listériose, la septicémie, l'abcès, l'encéphalite, la méningite, ou les fausses couches (Meng et al. 1997)... Par ailleurs, moins de 300 cas sont recensés chaque année en France (essentiellement des immuno-déprimés, enfants et femmes enceintes).
La listériose se propage par la consommation d'aliments contaminés. Elle affecte les macrophages et les cellules épithéliales (cellules M des plaques de Peyer et/ou les entérocytes).
Bien qu'il existe des antibiothérapies adaptées, le taux de mortalité reste aux environs de 30% (Vazquez-Boland et al. 2001) et les taux de séquelles neurologiques sont de l'ordre de 40%.
II. Caractéristiques de la Listeria monocytogenes favorisant sa pathogénicité
- intracellulaire facultative,
- saprophyte et anthropo-zoonose,
- capable de survivre et de croître à l'intérieur de la plupart des cellules d'un hôte,
- invasive,
- mobile mais thermo-régulée (transcription downrégulée à 37ºC des gènes codant pour les flagelles).
III. Tableau des caractéristiques et des fonctions biologiques des différentes protéines
Tableau d'exemples de pMHC présentant des peptides tumoraux :
| Gène | Protéine | Taille | Fonctions | Caractéristiques |
|---|---|---|---|---|
| prfA | Protéine de la famille des CRP / FNR | 27,1kDa | - Facteur de transcription activateur ou répresseur de gènes bactériens. - Contrôle positif des gènes aux propriétés de virulence (plc, inl, mpl, hly) (Portnoy et al. 1992, Cossart et al. 1998, Dussurget et al. 2004). |
Expression thermo-dépendante (réprimée à température faible et max à 37ºC) et gluso-dépendante (inhibition en présence de glucose) (Chatterjee et al. 2006). |
| plcA | Phosphatidylinositol phospholipase C (PI-PLC) (Portnoy et al. 2002) | - Lyse de la membrane. - Activation de la réponse immunitaire. |
||
| plcB | Précurseur de la phosphatidylinositol specifique de la phospholipase C (PC-PLC) (Portnoy et al. 2002) | - Lyse de la double membrane de la vacuole par clivage de la phosphatidyl-choline, de la phosphatidyl-sérine et de la phosphatidyl-éthanolamine. - Activation de la réponse immunitaire. |
Activité protéique pH-dépendante : optimale pour un pH compris entre 5,5 et 7 (Portnoy et al. 2002). | |
| inlA | Internaline A | 800AA | Internalisation de la bactérie, d'où invasion de la cellule hôte. | |
| inlB | Internaline B | 630AA | Internalisation de la bactérie, d'où invasion de la cellule hôte (Dramsi et al. 1995, Braun et al. 1997, Braun et al. 1998, Jonquières et al. 1999). | |
| mpl | Métalloprotéase | 35kDa | - Clivage du précurseur de la phospholipase C qui rend l'enzyme active. - Dégradation de l'actine pour favoriser la croissance de la bactérie (utilisation des produits de clivage nécessaires à sa croissance intracellulaire) (Coffey et al. 2000). |
Antigène présenté par le MHC-Ia aux lymphocytes T CD8+ cytotoxiques (Pamer 2004). |
| Hly (lisA ou AVBS ou LLO | Hémolysine thiol dépendante listeriolysine O | 58kDa | - Croissance. - Lyse des phagosomes : liaison au cholestérol, oligomérisation de LLO, puis insertion dans la bicouche lipidique des feuillets de LLO et création de pores (Vazquez-Boland et al. 2001). |
- Activité protéique pH-dépendante : optimale pour pH 5,5 (Portnoy et al. 1992). - Antigène immunodominant présenté par le MHC-Ia aux lymphocytes T CD8+ cytotoxiques (Pamer 2004). |
| actA | Actine | - Pénétration dans la cellule hôte. - Mode de propulsion de la bactérie (mouvement intra et intercellulaire). |
||
| lmo0593 | Transporteur de nitrite (permet la survie de la bactérie dans des conditions privées d'oxygène) (Chatterjee et al. 2006). | |||
| lmo1538, lmo1539, OVM 1293 | Permet le métabolisme du glycérol (source de carbone supplémentaire) pour la croissance des bactéries intracellulaire. | |||
| ftsZ, ftsA | Nécessaires à la réplication de la bactérie et donc à la division cellulaire. | Réprimées par la cellule infectée. |
IV. Infection d'une cellule par la Listeria monocytogenes
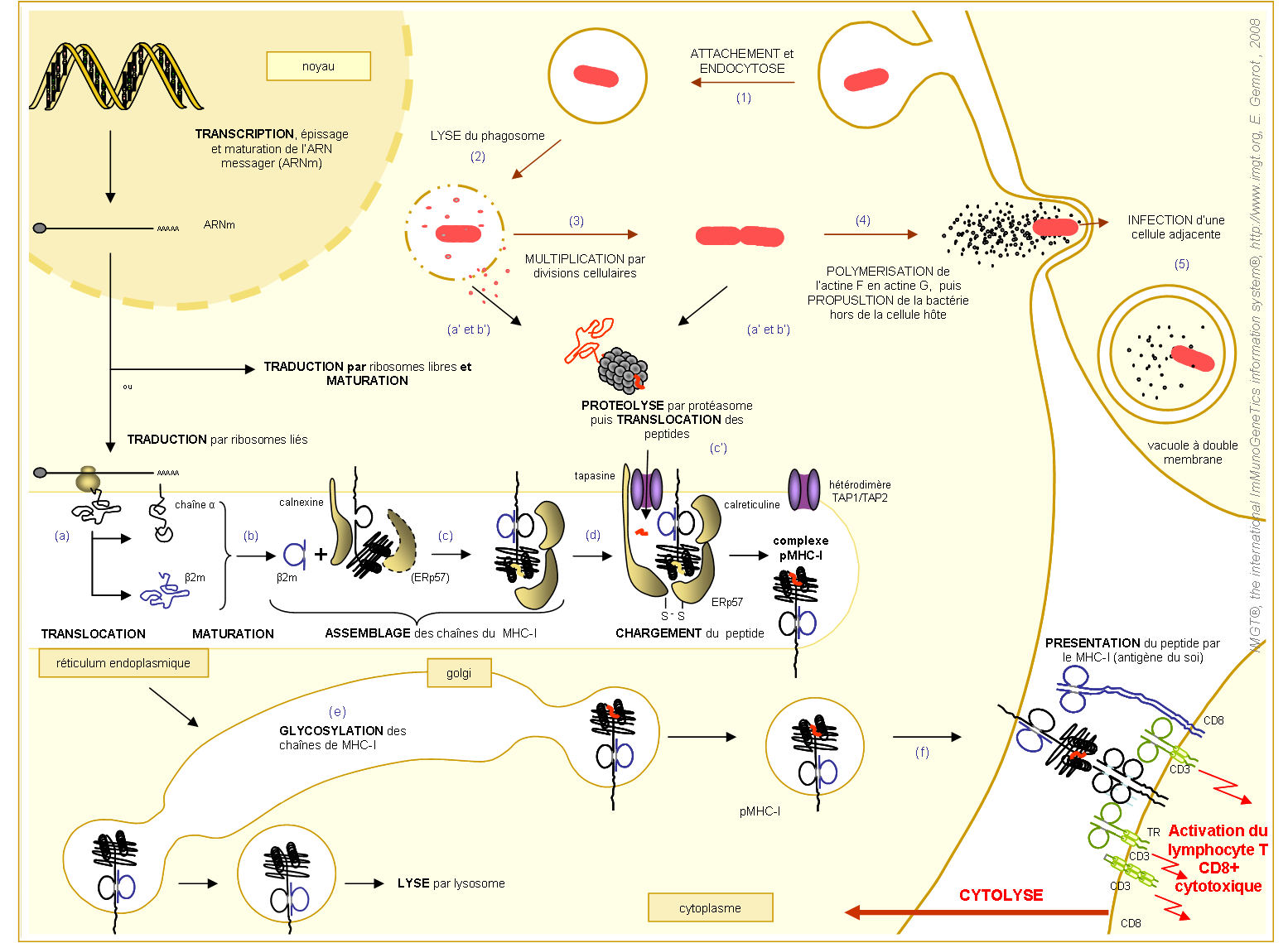 Figure. Cycle de réplication de la Listeria monocytogenes, étapes de l'expression à la surface cellulaire d'un complexe pMHC-Ia et présentation d'un peptide exogène bactérien par MHC-Ia au récepteur T d'un lymphocyte T CD8+ (Pamer 2004).
Figure. Cycle de réplication de la Listeria monocytogenes, étapes de l'expression à la surface cellulaire d'un complexe pMHC-Ia et présentation d'un peptide exogène bactérien par MHC-Ia au récepteur T d'un lymphocyte T CD8+ (Pamer 2004).
S'agissant d'un peptide bactérien (en rouge), le lymphocyte T CD8+ est activé. En résulte la destruction de la cellule infectée par cytolyse. Les principaux antigènes bactériens sont issus des protéines listeriolysine O (LLO), zinc metalloproteinase (mpl) et murine hydrolase (p60) (Pamer 2004). La voie de dégradation des peptides protéiques est indiquée par les lettres « a'» à « c'». La voie de biosynthèse des MHC-I et de leur chargement en peptides sont indiqués par les lettres « a » à « f ». Le cycle de réplication de Listeria monocytogenes est indiqué par les chiffres de « 1 » à « 5 » et détaillé ci-dessous.
Cycle de réplication de la bactérie Listeria monocytogenes (figure).
(1) La Listéria, une fois la barrière intestinale franchie, se déplace jusqu'à rencontrer un macrophage, une cellule dendritique ou une cellule à infecter. Afin de pénétrer dans les cellules hôtes, la bactérie utilise des protéines de la famille des internalines. Cette famille est composée d'une dizaine de protéines différentes (InlA, InlB, InlC, InlC2, InlD, InlE, InlF, InlG, et InlH) (Marrino et al. 2000), mais seules les protéines membranaires InlA et InlB ont un rôle primordial dans la pénétration du pathogène.
L'internalisation de la bactérie se fait par l'intermédiaire de deux grandes voies :
- la voie de l'InlA (principalement lors d'infection de cellules épithéliales). Cette voie fait intervenir l'internaline A bactérienne et la molécule d'adhésion E-cadhérine des cellules hôtes (Mengaud et al. 1996). L'association de la région LRR (Leucine Rich Repeat region) de l'internaline A (Dussurget et al. 2004) avec des hecto-domaines de la E-cadhérine est nécessaire et suffisante pour promouvoir l'internalisation de la Listéria.
- la voie de l'InlB (principalement pour l'invasion des hépatocytes en culture, des cellules HeLa, HEp2 et Vero). L'internaline B se lie principalement au récepteur du facteur de croissance des hépatocytes (Met) (Dussurget et al. 2004). Par ailleurs, elle peut également se lier au récepteur gC1qR (Braun et al. 2000) ou aux glycosaminoglycanes (GAGs) (Jonquières et al. 2001). Toutefois, contrairement à l'InIA, la protéine InlB ne permet pas, à elle seule, la pénétration de la bactérie dans les hépatocytes.
Quelle que soit la voie utilisée, la liaison de l'internaline bactérienne à un récepteur membranaire de la cellule hôte induit des réactions en cascades qui conduisent à la réorganisation du cytosquelette d'actine cellulaire et part là même, à la phagocytose du pathogène (Marino et al. 2000).
D'autres protéines bactériennes de surface participent à la pénétration dans des cellules eucaryotes. Ils s'agit de la protéine p60 (muréine hydrolase), d'une protéine analogue à InlA et InlB nommée Irp (internalin related protein), de la protéine actA, de alpha-D-galactose et d'une protéine de surface de 55,3kDa.
Une fois internalisée, la bactérie modifie l'expression de ses gènes pathogènes et métaboliques par rapport à son nouvel environnement. Ainsi, la bactérie régule ses gènes de virulence plcA, plcB, AVBS ou LLO, mpl et actA par l'intermédiaire de son facteur de transcription prfA (Leimeister-Wachter et al. 1990, Leimeister-Wachter et al. 1991 et Chakraborty et al. 1992).
(2) Afin de ne pas être détruite par les enzymes lytiques de la cellule hôte, la bactérie lyse la paroi du phagosome en sécrétant des phospholipases (PI-PLC et PC-PLC) et l'exotoxine hémolytique LLO (listériolysine O). La LLO permet la formation de pores (Portnoy et al. 1992) tandis que les phospholipases C permettent principalement un démantèlement de la membrane du phagosome.
Par ailleurs, il est à noter que les protéines LLO et PI-PLC interviennent également dans d'autres processus comme l'internalisation et l'évasion de la Listeria monocytogenes en modulant des signaux des cellules infectées (au niveau du métabolisme des phospholipides, et au niveau des concentrations en Ca2+ intracellulaire) en activant la protéine kinase C (PKC bêta) (Poussin et al. 2005) et la phospholipase C de la cellule hôte. De plus, PI-PLC et PC-PLC ont un effet sur l'activation de la réponse immunitaire au cours de l'infection par la bactérie par l'intermédiaire du facteur de transcription NF-kB.
(3) Une fois dans le cytoplasme, la Listeria monocytogenes modifie son métabolisme et sa source de carbone, en utilisant du glycérol à la place du glucose. Cette stratégie permet à la bactérie de ne pas porter préjudice à la cellule hôte et d'éviter l'inhibition de l'expression de prfA (Chatterjee et al. 2006).
La bactérie se multiplie par divisions cellulaires.
(4) La polymérisation de l'actine F bactérienne en actine G induit la formation d'une pseudo-capsule et d'une queue (comète). L'association de la queue d'actine filamenteuse au pôle bactérien permet la propulsion de la bactérie hors de la cellule (6-60 µm/min suivant la cellule infectée). Néanmoins d'autres molécules sont également nécessaires à la propulsion de la bactérie [ex: 3,4,5-Phosphatidylinositol biphosphate (ptdins (4,5) P3), la phosphatidylinositol3,4,5-biphosphate (ptdins (4,5) P2)] .
(5) Lorsque la bactérie atteint la membrane cytoplasmique, elle se propage d'une cellule à une autre sans exposition au milieu extracellulaire (Pizarro-Cerda et al. 2006). En effet, elle induit la formation de protubérances cellulaires (protrusions) qui seront phagocytées par la cellule adjacente pour donner naissance à des vacuoles à double membrane (Camilli et al. 1989). Après lyse de ses vacuoles, la bactérie peut initier un autre cycle infectieux.
La Listeria monocytogenes colonise les tissus par diffusion de cellules à cellules.
V. Bibliographie
Braun, L., Dramsi, S., Dehoux, P., Bierne, H., Lindahl, G., Cossart, P., InlB: an invasion protein of Listeria monocytogenes with a novel type of surface association, Mol. Microbiol., 25, 285-294 (1997).
Braun, L., Ohayon, H., Cossart, P., The InlB protein of Listeria monocytogenes is sufficient to promote entry into mammalian cells, Mol. Microbiol., 27, 1077-1088 (1998).
Braun, L., Gebrehiwet, B., Cossart, P., gC1q-R/p32, a C1q-binding protein, is a receptor for the InIB invasion protein of Listeria monocytogenes, EMBO J., 19, 1458-1466 (2000).
Camilli, A., Tilney, L.G., Portnoy, D.A., Dual roles of plcA in Listeria monocytogenes pathogenesis, Molecular Microbiology, 8, 143-157 (2006).
Chakraborty, T., Leimeister-Wachter, M., Domann, E., Hartl, M., Oebel, W., Nichterlein, T., Notermans, S., Coordinate Regulation of Virulence Genes in Listeria monocytogenes Requires the Product of the prfA Gene, Journal of bacteriology, 174, 568-574 (1992).
Chatterjee, P.K., Subhra, S., Hossain, H., Otten, S., Kuenne, C., Kuchmina, K., Machata, S., Domann, E., Chakraborty, T., Hain, T., Intracellular Gene Expression Profile of Listeria monocytogenes, Infection and Immunity, 74, 1323-1338 (2006).
Coffey, A., Van Den Burg, B., Veltman, R., Abee, T., Characteristics of the biologically active 35-kDa metalloprotease virulence factor from Listeria monocytogenes, J. Appl. Microbiol., 88, 132-141 (2000).
Cossart , P., Lecuit, M., Interactions of Listeria monocytogenes with mammalian cells during entry and actin-based movement : bacterial factors, cellular ligands and signalling, EMBO J., 17, 3797-3806 (1998).
Czuprynski, C.J., Listeria monocytogenes: silage, sandwiches and science, Anim Health Res Rev, 6(2), 211-217 (2005).
Dramsi, S., Biswas, I., Maguin, E., Braun, L., Mastroeni, P., Cossart, P., Entry of Listeria monocytogenes into hepatocytes requires expression of InlB, a surface protein of the internalin multigene family, Mol. Microbiol., 16, 251-261 (1995).
Dussurget, O., Pizarro-Cerda, J., Cossart, P., Molecular determinants of Listeria monocytogenes virulence, Ann. Rev. Microbiol., 58, 587-610 (2004).
Jonquières, R., Bierne, H., Fiedler, F., Gopunon, P., Cossart, P., Interactions between the protein InlB of Listeria monocytogenes and lipotechoic acid: a novel mechanism of association at the surface of gram positive bacteria, Mol. Microbiol., 34, 902-914 (1999).
Jonquières, R. Pizarro-Cerda, J., Cossart, P., Synergy between the N and C-terminal domains of InlB for efficient invasion of non-phagocytic cells by Listeria monocytogenes, Mol. Microbiol., 42, 955-965 (2001).
Leimeister-Wachter, M., Haffner, C., Domann E., Goebel, W., Chakraborty T., Identification of a gene that positively regulates expression of listeriolysin, the major virulence factor of Listeria monocytogenes, Proc. Natl. Acad. Sci., 87, 8336-8340 (1990).
Leimeister-Wachter, M., Domann, E., Chakraborty, T., Detection of a gene encoding a phosphatidylinositol-specific phospholipase C that is coordinately expressed with listeriolysin in Listeria monocytogenes, Mol. Microbiol., 5, 361-366 (1991).
Marino, M., Braun, L., Cossart, P., Ghosh, P., A Framework for Interpreting the Leucine-Rich Repeats of the Listeria Internalins, The Nation Academy Sciences, 97, 8784-8788 (2000).
Meng, J., Doyle, M.P., Emerging issues in microbiological food safety, Annu. Rev. Nutr. 17, 255-275 (1997).
Mengaud, J., Ohayon, H., Gounon, P., Mege, R.M., Cossart, P., E-cadherin is the receptor for internalin, a surface protein required for entry of Listeria monocytogenes into epithelial cells. Cell, 84, 923-932 (1996).
Pamer, E.G., Immune responses to Listeria monocytogenes, Nat. Rev. Immunol., 4(10), 812-823 (2004).
Pizarro-Cerda, J., Cossart, P., Subversion of cellular functions by Listeria monocytogenes, J. Pathol., 208(2), 215-223 (2006).
Portnoy, D.A., Chakraborty, T., Goebei, W., Cossart. P., Molecular determinants of Listeria monocytogenas pathogenesis, Infect tmmun, 60, 1263-1267 (1992).
Portnoy, D.A., Auerbuch, V., J. Glomski, I., The Cell Biology of Listeria monocytogenes Infection: the Intersection of Bacterial Pathogenesis and Cell-Mediated Immuntiy, The Journal of Cell Biology, 158, 409-414 (2002).
Poussin, M.A., Goldfine, H., Involvement of Listeria monocytogenes Phosphatidylinositol-Specific Phospholipase C and Host Protein Kinase C in Permeabilization of the Macrophage Phagosome, Infection and Immunity, 73, 4410-4413 (2005).
Vazquez-Boland, J.A., Kuhn, M., Berche, P., Chakraborty, T., Dominguez-Bernal, G., Goebel, W., et al., Listeria pathogenesis and molecular virulence determinants, Clin. Microbiol. Rev., 14(3), 584-640 (2001).



