La superfamille des immunoglobulines (IgSF)
141 rue de la Cardonille, 34396 Montpellier Cedex 5 (France)
Tel. : +33 (0)4 11 75 97 28 /+33 (0)4 11 75 97 29 - Fax : +33 (0)4 34 35 99 01
E-mail Marie-Paule.Lefranc@igh.cnrs.fr, IMGT: http://www.imgt.org
Duprat, E., et al.,
"IMGT standardization for alleles and mutations of the V-LIKE-DOMAINs and
C-LIKE-DOMAINs of the immunoglobulin superfamily"
Recent Research Developments in Human Genetics, 2004, 2, 111-136, LIGM:290
![]()
SOMMAIRE
IntroductionIntroduction
Les immunoglobulines (IG) sont constituées d'un homodimère de récepteurs aux antigènes ; chaque récepteur comprend deux chaînes protéiques constituées d'un V-DOMAIN (Lefranc et al. 2003) et d'un ou plusieurs C-DOMAINs (Lefranc et al. 2005). Des domaines de structure 3D similaire ont été identifiés au sein de protéines impliquées dans une grande variété de processus biologiques ; les protéines composées d'au moins un V-LIKE-DOMAIN (Lefranc et al. 2003) ou C-LIKE-DOMAIN (Lefranc et al. 2005) appartiennent à la superfamille des immunoglobulines (IgSF). A l'exception des IG et TR qui sont spécifiques des vertébrés à machoire, les protéines de cette superfamille sont observées chez les vertébrés et invertébrés, chez les virus, les champignons et les plantes (Halaby and Mornon 1998, Du Pasquier 2001). Ces protéines sont essentiellement impliquées dans le système immunitaire (MHC-I, MHC-II, B2M, famille des Fc récepteurs, famille des protéines KIR) ou dans des fonctions de structure et d'adhésion cellulaire (CEACAM1, MOG, MPZ, VCAM1) (Duprat et al. 2005).
- Protéines impliquées dans la réponse immunitaire
- Récepteurs des antigènes
- Immunoglobulines (IG)
Lefranc M-P and Lefranc G, The Immunoglobulin Factsbook, Academic Press, London, UK, 2001.
- Récepteurs T (TR)
Lefranc M-P and Lefranc G, The T cell receptor Factsbook, Academic Press, London, UK, 2001.
- Immunoglobulines (IG)
- Protéines autres que les IG et TR
- MHC-I
Les protéines MHC-I sont constituées de deux chaînes polypeptidiques liées de façon non covalentes: une chaîne lourde transmembranaire I-ALPHA et la beta2-microglobuline (B2M) ; la B2M se lie à la chaîne I-ALPHA dans le réticulum endoplasmique. Le domaine C-terminal de la chaîne I-ALPHA des protéines MHC-I est un C-LIKE-DOMAIN ; la B2M protéine comprend un unique domaine protéique (C-LIKE-DOMAIN), codé par un gène non polymorphe localisé sur le chromosome 15 chez l'homme (Oliver et al. 1978). Le gène de la B2M n'est pas lié au locus MHC-I (Trowsdale 1993), et la régulation de leur expression est indépendante (Jaffe et al. 1991).
- MHC-II
Les protéines MHC-II sont des hétérodimères constitués de deux chaînes transmembranaires II-ALPHA et II-BETA ; le domaine C-terminal des chaînes II-ALPHA et II-BETA est un C-LIKE-DOMAIN.
- Famille des Fc récepteurs
Les Fc récepteurs assurent le lien entre les complexes IG/antigène et les effecteurs cellulaires du système immunitaire ; l'interaction FcR/IG/antigène active des cellules effectrices aboutissant à la phagocytose, l'endocytose du complexe IG/antigène et le relargage de médiateurs inflammatoires (Chan and Sinclair 1971, Anderson et al. 1990). Des FcR ont été identifiés pour chaque classe d'IG (Ravetch and Kinet 1991, Hulett and Hogarth 1994, Daeron 1997) : FCGR pour les IgG, FCER pour les IgE, FCMR pour les IgM, FCAR pour les IgA et FCDR pour les IgD. Les différents types de récepteurs, leur affinité pour différentes régions Fc et le type de cellules qui les expriment contribuent à la diversité de la réponse immunitaire contre un antigène donné.
Les FcR sont des glycoprotéines membranaires constituées de 2 ou 3 C-LIKE-DOMAINs et appartiennent à IgSF, à l'exception de FCER2 qui est constitué de domaines de type lectine. Ces récepteurs sont codés par une famille multigénique localisée sur le chromosome 1q23 chez l'homme (Su et al. 2002) ; ces gènes sont polymorphes. Les récepteurs FCER et FCGR sont les plus étudiés ; parmi eux, FCGR1 et FCER1 sont des récepteurs de haute affinité pour les fragments Fc des IG monomériques tandis que les autres, tels que FCGR2 et FCGR3, reconnaissent les fragments Fc d'IG dimériques avec une faible affinité (Ravetch and Kinet 1991, Daeron 1997, Hulett and Hogarth 1994). Outre les variations d'affinité entre les récepteurs, chaque FCGR présente des spécificités distinctes pour les sous-types d'IgG ; par exemple, FCGR3 est plus spécifique des IgG1 et IgG3 que des IgG2 et IgG4 (Tamm and Schmidt 1997).
La structure 3D du complexe IgG1/FCGR3B a été déterminée (Sondermann et al. 2000, Radaev et al. 2001a). L'un des deux CH2 d'IgG1 interagit avec la région charnière entre les 2 C-LIKE-DOMAINs [D1] et [D2] de FCGR3B ; le C-LIKE-DOMAIN C-terminal [D2] de FCGR3B interagit de façon asymétrique avec les deux CH2 du fragment Fc.
- Famille KIR
Alors que la reconnaissance des protéines MHC-I par des récepteurs à la surface des cellules NK est une caractéristique commune d'Homo sapiens et de Mus musculus, les récepteurs diffèrent selon l'espèce (Colucci et al. 2002) :
- Les protéines MHC-I de Mus musculus sont reconnues par les récepteurs de la famille Ly49. Ces récepteurs sont constitués de domaines protéiques de type lectine (Takei et al. 1997), et ne présentent pas d'homologue chez Homo sapiens (Barten et al. 2001).
- Les protéines de la famille KIR reconnaissent les protéines MHC-I chez Homo sapiens. Ces récepteurs comportent 2 ou 3 C-LIKE-DOMAINs (Wagtmann et al. 1995) et appartiennent par conséquent à l'IgSF. Aucun homologue de ces protéines n'est connu chez Mus musculus (Valiante et al. 1997, Barten et al. 2001). De même, aucun homologue de la famille de récepteurs LIR d'Homo sapiens n'a été identifié chez Mus musculus ; ces protéines sont constituées de 2 ou 4 C-LIKE-DOMAINs (Samaridis and Colonna 1997).
La famille de récepteurs NKG2 est néanmoins représentée au sein de ces deux espèces ; ces protéines sont constituées de domaines protéiques de type lectine.
Les récepteurs des cellules NK sont codés par 2 groupes de gènes chez l'homme : le Natural Killer Complex (NKC, 12p13.2) qui comprend la famille multigénique NKG2, et le Leucocyte Receptor Complex (LRC, 19q13.42) qui comprend les familles multigéniques KIR et LIR ; les gènes KIR sont polymorphes. Chaque famille de récepteurs des cellules NK est constituée par des récepteurs activateurs et inhibiteurs (Suto et al. 1998), et l'activité d'une cellule NK est ainsi régulée par la balance entre les différents signaux induits par les récepteurs qu'elle exprime à sa surface.
- Les récepteurs inhibiteurs comportent des motifs ITIM (Immunoreceptor Tyrosine-based Inhibitory Motif) au niveau de leur région intracytoplasmique ; ces motifs sont impliqués dans le recrutement de tyrosine phosphatases qui transduisent le signal inhibiteur des cellules NK (Burshtyn et al. 1996).
- Les récepteurs activateurs ne comportent pas de motif spécifique au niveau de leur région intracytoplasmique, mais se lient aux protéines membranaires DAP10 ou DAP12 ; ces protéines présentent des motifs ITAM (Immunoreceptor Tyrosine-based Activation Motif) intracytoplasmiques et transduisent le signal activateur (Lanier et al. 1998).
La nomenclature des protéines KIR indique le nombre de domaines protéiques (de type C-LIKE) qu'elles comportent et le type de récepteur qu'elles constituent (activateur ou inhibiteur des cellules NK). Les protéines KIR2DL1-3, KIR2DL4 et KIR2DS1 comportent 2 domaines C-LIKE, tandis que KIR3DL1, KIR3DL2 et KIR3DS1 en comportent 3 ; les protéines KIR2DL1-3 (reconnaissent HLA-C), KIR2DL4, KIR3DL1 (reconnaît HLA-B) et KIR3DL2 (reconnaît HLA-A) sont inhibiteurs, tandis que KIR2DS1 et KIR3DS1 sont activateurs des cellules NK.
KIR2DL1-3, KIR3DL1 et KIR3DL2 reconnaissent respectivement les protéines HLA-C, HLA-B et HLA-A. La spécificité des protéines KIR pour MHC-I est allotypique mais pas allélique ; la mutation d'un unique acide aminé peut être responsable d'un changement de spécificité (Boyington and Sun 2002). La structure 3D des complexes HLA-Cw4/KIR2DL1 et HLA-Cw3/KIR2DL2 a été déterminée (Fan et al. 2001, Boyington et al. 2000). Les hélices des domaines G-ALPHA1 et G-ALPHA2 de MHC-I et le peptide qu'ils présentent interagissent avec les deux domaines protéiques N-terminaux des KIR ; leur mode de reconnaissance est de type clé-serrure et leur orientation par rapport aux hélices de MHC-I est similaire à celle des 2 domaines V des TR.
- MHC-I
- Récepteurs des antigènes
- Protéines impliquées dans l'adhésion cellulaire ou le développement
- MOG (myelin oligodendrocyte glycoprotein)
MOG est un composant essentiel du système nerveux central (CNS) et est exprimée spécifiquement par les cellules de la couche externe de la myéline mature (Brunner et al. 1989) ; elle contribue à la maturation et à la maintenance de la myéline (Birling et al. 1993). MOG est une protéine membranaire reconnue comme un agent pathogène par le système immunitaire des patients atteints de sclérose en plaques (Sun et al. 1991) ; cette maladie auto-immune aboutit à la démyélinisation progressive du CNS. Le gène MOG d'Homo sapiens comporte 8 exons et est colocalisé avec le MHC sur le chromosome 6 (Pham-Dinh et al. 1993a). La protéine MOG comprend un unique domaine, de structure similaire au domaine V des IG et TR : ce V-LIKE-DOMAIN est codé par le 2ème exon, et sa structure 3D a été déterminée pour la protéine MOG de Rattus norvegicus (Clements et al. 2003).
- CEACAM1 (carcinoembryonic antigen-related cell adhesion molecule 1)
CEACAM1 appartient à la famille des protéines CEA, constituées d'un domaine V-LIKE N-terminal suivi d'un nombre variable de domaines C-LIKE (Thompson et al. 1991). CEACAM1 comprend 3 domaines C-LIKE et est exprimée par les cellules d'origine épithéliale et myéloide (Hinoda et al. 1988) ; la perte ou la réduction de l'expression de cette protéine membranaire est observée dans le carcinogenèse colorectale (Neumaier et al. 1993).
- MPZ (myelin protein zero)
MPZ est une protéine membranaire exprimée par les cellules de Schwann au niveau de la couche périphérique des nerfs (en dehors du CNS) ; cette protéine permet l'adhésion des cellules adjacentes et stabilise la myéline. Ce rôle d'adhésion cellulaire est assuré par son unique domaine protéine : un domaine V-LIKE, codé par deux exons. Le gène est localisé sur le chromosome 1 chez l'homme (1q21.3-q23), à proximité du gène FCGR2A (Pham-Dinh et al. 1993b). Deux mutations au niveau des brins du domaine V-LIKE sont impliquées indépendamment dans la maladie Charcot-Marie-Tooth, caractérisée par une diminution progressive de la capacité de conduction de l'influx nerveux et par l'hypertrophie des cellules de Schwann (Hayasaka et al. 1993).
- VCAM1 (vascular cell adhesion molecule 1)
VCAM1 est exprimée dans les cellules endothéliales activées par les cytokines. Cette protéine membranaire se lie aux intégrines des lymphocytes B circulants et permet ainsi leur adhésion à l'endothélium vasculaire et la transduction du signal lié à la réponse inflammatoire (Osborn et al. 1989). VCAM1 est impliquée dans le développement de pathologies telles que l'artériosclérose et l'arthite rhumatoïde. Le gène VCAM1 comprend 9 exons, parmi lesquels l'exon 5 subit un épissage alternatif (Cybulsky et al. 1995) ; l'isoforme principale est constituée de 7 domaines C-LIKE. La structure 3D des deux domaines C-LIKE N-terminaux a été déterminée (Wang et al. 1995) ; ils sont impliqués dans l'interaction VCAM/intégrine et sont ainsi les médiateurs de l'adhésion cellulaire des lymphocytes B (Osborn et al. 1994).
- MOG (myelin oligodendrocyte glycoprotein)
- Protéines IgSF des invertébrés
- Amalgame
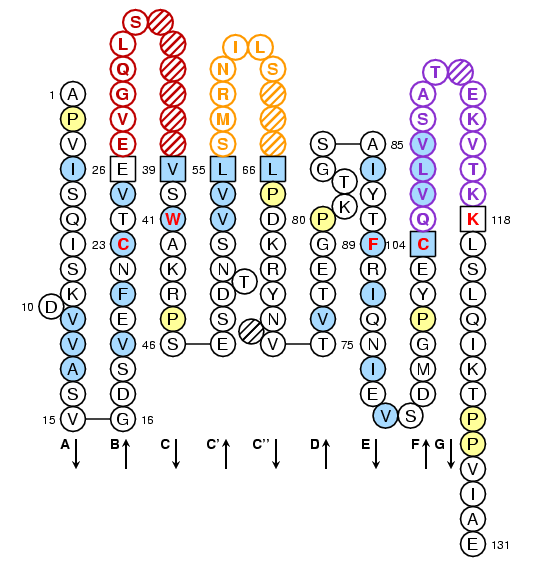
Drosophila melanogaster V-LIKE-DOMAIN: IMGT Collier de Perles
- Fascicline
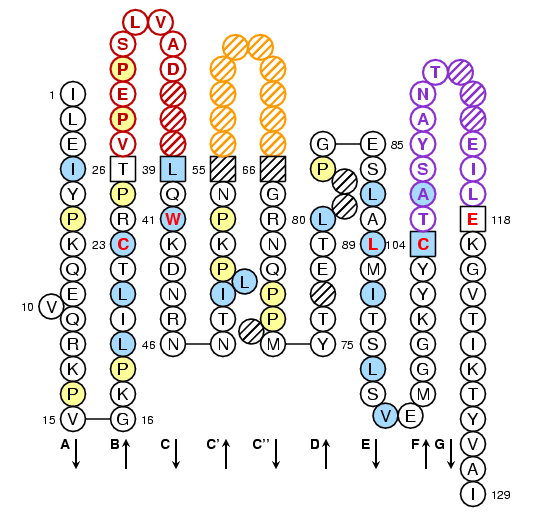
Drosophila melanogaster V-LIKE-DOMAIN: IMGT Collier de Perles
- Amalgame
Documents utiles
IMGT unique numbering for V-DOMAIN and V-LIKE-DOMAIN
IMGT unique numbering for C-DOMAIN and C-LIKE-DOMAIN
Etude des V-LIKE-DOMAINs
Bibliographie
Anderson, C.L., Shen, L., Eicher, D.M., Wewers, M.D. and Gill, J.K., Phagocytosis mediated by three distinct Fc gamma receptor classes on human leucocytes, J. Exp. Med., 1990, 171, 1333-1345.
Barten, R., Torkar, M., Haude, A., Trowsdale, J. and Wilson, M.J., Divergent and convergent evolution of NK-cell receptors, Trends Immunol., 2001, 22, 52-57.
Birling, M.C., Roussel, G., Nussbaum, F. and Nussbaum, J.L., Biochemical and immunohistochemical studies with specific polyclonal antibodies directed against bovine myelin/oligodendrocyte glycoprotein, Neurochem. Res., 1993, 18, 937-945.
Boyington, J.C., Motyka, S.A., Schuck, P., Brooks, A.G. and Sun, P.D., Crystal structure of an NK cell immunoglobulin-like receptor in complex with its class I MHC ligand, Nature, 2000, 405, 537-543.
Boyington, J.C. and Sun, P.D., A structural perspective on MHC class I recognition by killer cell immunoglobulin-like receptors, Mol. Immunol., 2002, 38, 1007-1021.
Brunner, C., Lassmann, H., Waehneldt, T.V., Matthieu, J.M. and Linington, C., Differential ultrastructural localization of myelin basic protein, myelin/oligodendroglial glycoprotein, and 2',3'-cyclic nucleotide 3'-phosphodiesterase in the CNS of adult rats, J. Neurochem., 1989, 52, 296-304.
Burshtyn, D.N., Scharenberg, A.M., Wagtmann, N., Rajagopalan, S., Berrada, K., Yi, T., Kinet, J.P. and Long, E.O., Recruitment of tyrosine phosphatase HCP by the killer cell inhibitor receptor, Immunity, 1996, 4, 77-85.
Chan, P.L. and Sinclair, N.R., Regulation of the immune response. An analysis of the function of the Fc portion of antibody in suppression of an immune response with respect to interaction with components of the lymphoid system, Immunology, 1971, 21, 967-981.
Clements, C.S., Reid, H.H., Beddoe, T., Tynan, F.E., Perugini, M.A., Johns, T.G., Bernard, C.C. and Rossjohn, J., The crystal structure of myelin oligodendrocyte glycoprotein, a key autoantigen in multiple sclerosis, Proc. Natl. Acad. Sci. USA, 2003, 100, 11059-11064.
Colucci, F., Di Santo, J.P. and Leibson, P.J., Natural killer cell activation in mice and men: different triggers for similar weapons? Nature Immunol., 2002, 3, 807-813.
Cybulsky, M.I., Fries, J.W., Williams, A.J., Sultan, P., Eddy, R., Byers, M., Shows, T., Gimbrone, M.A. and Collins, T., Gene structure, chromosomal location, and basis for alternative mRNA splicing of the human VCAM1 gene, Proc. Natl. Acad. Sci. USA, 1991, 88, 7859-7863.
Daeron, M., Fc receptor biology, Annu. Rev. Immunol., 1997, 15, 203-234.
Duprat, E., Kaas, Q., Garelle, V., Giudicelli, V., Lefranc, G. and Lefranc, M.-P., IMGT standardization for alleles and mutations of the V-LIKE-DOMAINs and C-LIKE-DOMAINs of the immunoglobulin superfamily, In: Recent Research Developments in Human Genetics, Trivandium, India, Research Signpost, 2004, 2, 111-136.
Fan, Q.R., Long, E.O. and Wiley, D.C., Crystal structure of the human natural killer cell inhibitory receptor KIR2DL1-HLA-Cw4 complex, Nature Immunol., 2001, 2, 452-460.
Hayasaka, K., Himoro, M., Wang, Y., Takata, M., Minoshima, S., Shimizu, N., Miura, M., Uyemura, K. and Takada, G., Structure and chromosomal localization of the gene encoding the human myelin protein zero (MPZ), Genomics, 1993, 17, 755-758.
Hinoda, Y., Neumaier, M., Hefta, S.A., Drzeniek, Z., Wagener, C., Shively, L., Hefta, L.J., Shively, J.E. and Paxton, R.J., Molecular cloning of a cDNA coding biliary glycoprotein I: primary structure of a glycoprotein immunologically crossreactive with carcinoembryonic antigen, Proc. Natl. Acad. Sci. USA, 1988, 85, 6959-6963.
Hulett, M.D. and Hogarth, P.M., Molecular basis of Fc receptor function, Adv. Immunol., 1994, 57, 1-127.
Jaffe, L., Robertson, E.J. and Bikoff, E.K., Distinct patterns of expression of MHC class I and beta 2-microglobulin transcripts at early stages of mouse development, J. Immunol., 1991, 147, 2740-2749.
Lanier, L.L., Corliss, B.C., Wu, J., Leong, C. and Phillips, J.H., Immunoreceptor DAP12 bearing a tyrosine-based activation motif is involved in activating NK cells, Nature, 1998, 391, 703-707.
 Lefranc, M.-P., Pommié, C., Ruiz, M., Giudicelli, V., Foulquier, E., Truong, L., Thouvenin-Contet, V. and Lefranc, G., IMGT unique numbering for immunoglobulin and T cell receptor variable domains and Ig superfamily V-like domains, Dev. Comp. Immunol., 2003, 27, 55-77
Lefranc, M.-P., Pommié, C., Ruiz, M., Giudicelli, V., Foulquier, E., Truong, L., Thouvenin-Contet, V. and Lefranc, G., IMGT unique numbering for immunoglobulin and T cell receptor variable domains and Ig superfamily V-like domains, Dev. Comp. Immunol., 2003, 27, 55-77
![]() with permission form Elsevier
with permission form Elsevier
 Lefranc, M.-P., Pommié, C., Kaas, Q., Duprat, E., Bosc, N., Guiraudou, D., Jean C., Ruiz M., Da Piedade, I., Rouard, M., Foulquier, E., Thouvenin, V. and Lefranc, G., IMGT unique numbering for immunoglobulin and T cell receptor constant domains and Ig superfamily C-like domains, Dev. Comp. Immunol., 2005, 29, 185-203
Lefranc, M.-P., Pommié, C., Kaas, Q., Duprat, E., Bosc, N., Guiraudou, D., Jean C., Ruiz M., Da Piedade, I., Rouard, M., Foulquier, E., Thouvenin, V. and Lefranc, G., IMGT unique numbering for immunoglobulin and T cell receptor constant domains and Ig superfamily C-like domains, Dev. Comp. Immunol., 2005, 29, 185-203
![]() with permission form Elsevier
with permission form Elsevier
Neumaier, M., Paululat, S., Chan, A., Matthaes, P. and Wagener, C., Biliary glycoprotein, a potential human cell adhesion molecule, is down-regulated in colorectal carcinomas, Proc. Natl. Acad. Sci. USA, 1993, 90, 10744-10748.
Oliver, N., Francke, U. and Pellegrino, M.A., Regional assignment of genes for mannose phosphate isomerase, pyruvate kinase-3, and beta 2-microglobulin expression on human chromosome 15 by hybridization of cells from a t(15;22) (q14;q13.3) translocation carrier, Cytogenet. Cell Genet., 1978, 22, 506-510.
Osborn, L., Hession, C., Tizard, R., Vassallo, C., Luhowskyj, S., Chi-Rosso, G. and Lobb, R., Direct expression cloning of vascular cell adhesion molecule 1, a cytokine-induced endothelial protein that binds to lymphocytes, Cell, 1989, 59, 1203-1211.
Osborn, L., Vassallo, C., Browning, B.G., Tizard, R., Haskard, D.O., Benjamin, C.D., Dougas, I. and Kirchhausen, T., Arrangement of domains, and amino acid residues required for binding of vascular cell adhesion molecule-1 to its counter-receptor VLA-4 (alpha 4 beta 1), J. Cell Biol., 1994, 124, 601-608.
Pham-Dinh, D., Mattei, M.G., Nussbaum, J.L., Roussel, G., Pontarotti, P., Roeckel, N., Mather, I.H., Artzt, K., Lindahl, K.F. and Dautigny, A., Myelin/oligodendrocyte glycoprotein is a member of a subset of the immunoglobulin superfamily encoded within the major histocompatibility complex, Proc. Natl. Acad. Sci. USA, 1993a, 90, 7990-7994.
Pham-Dinh, D., Fourbil, Y., Blanquet, F., Mattei, M.G., Roeckel, N., Latour, P., Chazot, G., Vandenberghe, A. and Dautigny, A., The major peripheral myelin protein zero gene: structure and localization in the cluster of Fc gamma receptor genes on human chromosome 1q21.3-q23, Hum. Mol. Genet., 1993b, 2, 2051-2054.
Radaev, S., Motyka, S., Fridman, W.H., Sautes-Fridman, C. and Sun, P.D., The structure of a human type III Fc gamma receptor in complex with Fc, J. Biol. Chem., 2001, 276, 16469-16477.
Ravetch, J.V. and Kinet, J.P., Fc receptors, Annu. Rev. Immunol., 1991, 9, 457-492.
Samaridis, J. and Colonna, M., Cloning a novel immunoglobulin superfamily receptors expressed on human myeloid and lymphoid cells: structural evidence for new stimulatory and inhibitory pathways, Eur. J. Immunol., 1997, 27, 660-665.
Sondermann, P., Huber, R., Oosthuizen, V. and Jacob, U., The 3.2 A crystal structure of the human IgG1 Fc fragment-Fc gamma RIII complex, Nature, 2000, 406, 267-273.
Su, K., Wu, J., Edberg, J.C., McKenzie, S.E. and Kimberly, R.P., Genomic organization of classical human low-affinity Fcgamma receptor genes, Genes Immun., 2002, 3, Suppl. 1, 51-56.
Sun, J., Link, H., Olsson, T., Xiao, B.G., Andersson, G., Ekre, H.P., Linington, C. and Diener, P., T and B cell responses to myelin-oligodendrocyte glycoprotein in multiple Sclerosis, J. Immunol., 1991, 146, 1490-1495.
Suto, Y., Ishikawa, Y., Kasahara, M., Kasai, F., Yabe, T., Akaza, T. and Juji, T., Gene arrangement of the killer cell inhibitory receptor family on human chromosome 19q13.4 detected by fiber-FISH, Immunogenetics, 1998, 48, 235-241.
Takei, F., Brennan, J. and Mager, D.L., The Ly-49 family: genes, proteins and recognition of class I MHC, Immunol. Rev., 1997, 155, 67-77.
Tamm, A. and Schmidt, R.E., IgG binding sites on human Fc gamma receptors, Int. Rev. Immunol., 1997, 16, 57-85.
Thompson, J.A., Grunert, F. and Zimmermann, W., Carcinoembryonic antigen gene family: molecular biology and clinical perspectives, J. Clin. Lab. Anal., 1991, 5, 344-366.
Trowsdale, J., Genomic structure and function in the MHC, Trends Genet., 1993, 9, 117-122.
Valiante, N.M., Lienert, K., Shilling, H.G., Smits, B.J. and Parham, P., Killer cell receptors: keeping pace with MHC class I evolution, Immunol. Rev., 1997, 155, 155-164.
Wagtmann, N., Biassoni, R., Cantoni, C., Verdiani, S., Malnati, M.S., Vitale, M., Bottino, C., Moretta, L., Moretta, A. and Long, E.O., Molecular clones of the p58 NK cell receptor reveal immunoglobulin-related molecules with diversity in both the extra- and intracellular domains, Immunity, 1995, 2, 439-449.
Wang, J.H., Pepinsky, R.B., Stehle, T., Liu, J.H., Karpusas, M., Browning, B. and Osborn, L., The crystal structure of an N-terminal two-domain fragment of vascular cell adhesion molecule 1 (VCAM-1): a cyclic peptide based on the domain 1 C-D loop can inhibit VCAM-1-alpha 4 integrin interaction, Proc. Natl. Acad. Sci. USA, 1995, 92, 5714-5718.



